你可能感兴趣的试题
密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入 催化剂 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
该反应是化合反应 该反应是分解反应 该变化中共涉及三种物质 该变化中原子不可分
密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
反应前后原子的种类不变 该反应的基本类型为置换反应 参加反应的甲、乙分子个数比为1:1 该反应符合质量守恒定律
置换反应 化合反应 分解反应 复分解反应 
密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应
物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
2NO+O2=2NO2 化合反应 2H2S+O2=2H2O+2S↓ 置换反应 2HI=H2+I2 分解反应 2HI+Cl2=2HCl+I.2 置换反应
2CO+O2 2CO2 化合反应 2HI+Cl2═2HCl+I2 置换反应 2H2O
2CO2 化合反应 2HI+Cl2═2HCl+I2 置换反应 2H2O 2H2↑+O2↑ 分解反应 2HCl+CuO═CuCl2+H2O 复分解反应
2H2↑+O2↑ 分解反应 2HCl+CuO═CuCl2+H2O 复分解反应
该反应属于化合反应 反应前后原子数目发生变化 反应前后各元素化合价均不变 反应前后元素种类发生变化
2CO + O2 2CO2 化合反应 2HI + Cl2 ==== 2HCl + I2 置换反应 2H2O ===== 2H2↑ + O2↑ 分解反应 2HCl + CuO ==== CuCl2 + H2O 复分解反应
2CO2 化合反应 2HI + Cl2 ==== 2HCl + I2 置换反应 2H2O ===== 2H2↑ + O2↑ 分解反应 2HCl + CuO ==== CuCl2 + H2O 复分解反应
2CO+O2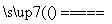 2CO2 化合反应 2HI+Cl2===2HCl+I2 置换反应 2H2O
2CO2 化合反应 2HI+Cl2===2HCl+I2 置换反应 2H2O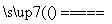 2H2↑+O2↑ 分解反应 2HCl+CuO===CuCl2+H2O 复分解反应
2H2↑+O2↑ 分解反应 2HCl+CuO===CuCl2+H2O 复分解反应
反应前后各元素化合价不变 该化学变化中发生改变的微粒是原子 该反应不符合质量守恒定律 参加反应的CO2和H2分子个数比为1:3
密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
置换反应 化合反应 分解反应 复分解反应 
2CO+O2 2CO2 化合反应 2HI+Cl2===2HCl+I2 置换反应 2H2O
2CO2 化合反应 2HI+Cl2===2HCl+I2 置换反应 2H2O 2H2↑+O2↑ 分解反应 2HCl+CuO===CuCl2+H2O 复分解反应
2H2↑+O2↑ 分解反应 2HCl+CuO===CuCl2+H2O 复分解反应
所有化学反应在反应前后分子个数都不发生变化 此反应过程中只有物质变化,没有能量变化 在任何条件下,H2和Cl2均不能大量共存 由微观示意图可知:2g H2和71g Cl2发生反应可生成73g HCl

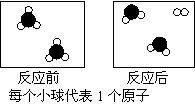

 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应
物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
 2CO2 化合反应 2HI+Cl2═2HCl+I2 置换反应 2H2O
2CO2 化合反应 2HI+Cl2═2HCl+I2 置换反应 2H2O 2H2↑+O2↑ 分解反应 2HCl+CuO═CuCl2+H2O 复分解反应
2H2↑+O2↑ 分解反应 2HCl+CuO═CuCl2+H2O 复分解反应
 2CO2 化合反应
2CO2 化合反应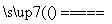 2CO2 化合反应 2HI+Cl2===2HCl+I2 置换反应 2H2O
2CO2 化合反应 2HI+Cl2===2HCl+I2 置换反应 2H2O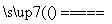 2H2↑+O2↑ 分解反应 2HCl+CuO===CuCl2+H2O 复分解反应
2H2↑+O2↑ 分解反应 2HCl+CuO===CuCl2+H2O 复分解反应

 2CO2 化合反应 2HI+Cl2===2HCl+I2 置换反应 2H2O
2CO2 化合反应 2HI+Cl2===2HCl+I2 置换反应 2H2O 2H2↑+O2↑ 分解反应 2HCl+CuO===CuCl2+H2O 复分解反应
2H2↑+O2↑ 分解反应 2HCl+CuO===CuCl2+H2O 复分解反应