你可能感兴趣的试题
常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+) 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L: c(Na+) = c(CH3COOH) > c(CH3COO-) > c(H+) = c(OH-) 常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中 的值减小到原来的
的值减小到原来的
常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 常温下,反应 (s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0 C.常温下,将pH =10的氨水稀释后,溶液中所有离子浓度都减小 常温下,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
25 ℃时,向水中加入少量固体NaHSO4,c(H+)增大,K.w不变 向0.1 mol·L-1CH3COOH溶液中加入少量的CH3COONa晶体, 减小 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的K.sp减小 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小
减小 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的K.sp减小 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小
稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3 COO -) 在氯水中通入氯化氢气体后,溶液中c(HClO)减小 常温下,pH =2的盐酸与pH =12的氨水等体积混合所得溶液中: c(Cl-)>c(NH4+)>c(H+)>c(OH-)
稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3 COO-) 在含有BaSO4沉淀的溶液中加入Na2SO4固体,溶液中c(Ba2+)减小 常温下,pH =2的盐酸与pH =12的氨水等体积混合所得溶液c(H+)>c(OH-)
常温下,CH3COOH分子可能存在于pH>7的碱性溶液中 60℃时,NaCl溶液的pH<7,则溶液呈酸性 将pH=4的CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小 相同温度下,1 mol·L-1氨水与0.5 mol·L-1氨水中c(OH-)之比是2:1
醋酸溶液中离子浓度的关系满足:c(H+)=c(OH﹣)+c(CH3COO﹣) 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH﹣)减小 CH3COOH溶液中加少量的CH3COONa固体,电离平衡逆向移动 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
常温下,向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 0.1 mol·L-1的醋酸加水稀释,c(CH3COOH)/c(CH3COO-)减小 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性
水的离子积常数K.W.只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 K.sp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 常温下,向10mL PH=3的醋酸溶液中加水稀释后,溶液中 C.(CH3COO--)/C(CH3COOH) C(OH--)的值减小 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH )/c(NH3·H2O)的值增大
)/c(NH3·H2O)的值增大
0.1 mol·L-1CH3COOH溶液加水稀释,溶液中所有离子浓度均减小 常温下,在由水电离出的c(OH-)=1×10-12mol•L-1的溶液中,Al3+可能大量存在 常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 常温下,相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小
向冰醋酸中加水至配成醋酸稀溶液的过程H+的浓度逐渐减小 在稀溶液中:H+(aq) + OH-(aq) = H2O(l); △H=-57.3kJ/mol,则含1 mol HClO的稀溶液和含1 mol KOH的稀溶液完全反应放出的热量等于57.3 kJ 常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况
c(H+)>c(OH-)的溶液一定显酸性 将0.1 mol·L-1HI溶液加水稀释l00倍,溶液中所有离子的浓度随之减小 常温下pH=5的硫酸溶液稀释到原来的1000倍,稀释后c(SO42-)与c(H+)之比约为1∶20 常温下的纯水加热到40℃,pH减小
溶液的pH增加 CH3COOH电离度变大 溶液的导电能力减弱 溶液中c(OH-)减小
60℃时,NaCl溶液的pH<7,则溶液呈酸性 将pH=4的 CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小 常温下,CH3COOH分子可能存在于pH>7的减性溶液中 相同温度下,1 mol/L氨水与0.5 mol/L氨水中c(OH-)之比是2:1
常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中 的值增大到原来的100倍 常温下,0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积恰好反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) 常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
的值增大到原来的100倍 常温下,0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积恰好反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) 常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
溶液中的c(H+)减小 电离平衡左移,电离常数减小 溶液的导电能力减弱 溶液中的c(OH-)减小
常温下,等浓度的CH3COONa溶液和NaCN溶液的PH前者较小 在NaCN溶液中:c (Na+)+ c (H+) =c (OH-)+ c (CN-) 相同温度下,相同PH的CH3COOH和HCN溶液分别加水稀释,溶液PH随溶液体积变化的曲线如图1所示 常温下,CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与盐浓度的变化曲线如图2所示
常温下,pH等于14与pH等于12的两种NaOH溶液等体积混合后, c(H+)=(10-14+10-10)/2 常温下,浓度为1×10-10 mol·L.-1的KOH溶液的pH为7 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 常温下,pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等
NaHSO3和NaHCO3的混合溶液中(S.和C.均用R.表示):  常温下物质的量浓度相等的
常温下物质的量浓度相等的 
 三种溶液中水的电离程度:③>①>② 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-) 与pH值的关系如右图所示,当pH=4.5溶液中:
三种溶液中水的电离程度:③>①>② 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-) 与pH值的关系如右图所示,当pH=4.5溶液中: 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 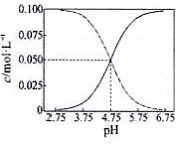

 的值减小到原来的
的值减小到原来的
 减小 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的K.sp减小 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小
减小 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的K.sp减小 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小
 )/c(NH3·H2O)的值增大
)/c(NH3·H2O)的值增大
 的值增大到原来的100倍 常温下,0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积恰好反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) 常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
的值增大到原来的100倍 常温下,0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积恰好反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) 常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
 常温下物质的量浓度相等的
常温下物质的量浓度相等的 
 三种溶液中水的电离程度:③>①>② 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-) 与pH值的关系如右图所示,当pH=4.5溶液中:
三种溶液中水的电离程度:③>①>② 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-) 与pH值的关系如右图所示,当pH=4.5溶液中: 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 