你可能感兴趣的试题
Br2在反应中表现还原性 1mol氧化剂在反应中得到2mol电子 Br2在反应中失去电子 SO2在反应中被氧化
NO2由反应 生成 总反应可表示为
生成 总反应可表示为 还可能发生的反应有
还可能发生的反应有 还可能发生的反应有
还可能发生的反应有
反应①中X.的化学式为NO 反应①、②都属于氧化还原反应 反应①、②中涉及的氧化物共有5种 化石燃料的燃烧是导致酸雨的“罪魁”
2C+O2  2CO 2SO2+ O2
2CO 2SO2+ O2  2SO3 S + O2
2SO3 S + O2  SO2 SO3+ H2O === H2SO4
SO2 SO3+ H2O === H2SO4
潮湿的氯气通过盛有浓H2SO4的洗气瓶 硫化氢通入浓H2SO4中 浓H2SO4滴入萤石中,加热 加入少量H2SO4使乙酸乙酯水解
Br2在反应中表现氧化性 SO2在反应中被还原 Br2在反应中失去电子 1mol氧化剂在反应中得到1mol电子
此过程中没有分解反应 此过程中S.元素的化合价未发生改变 使用此废气处理装置可减少酸雨的形成 整个过程的反应可表示为: 2SO2+2CaCO3+O2=2CaSO4+2CO2 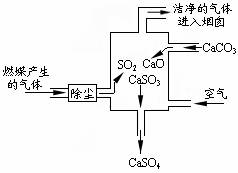
Br2在反应中表现还原性 SO2在反应中被还原 Br2在反应中失去电子 1mol氧化剂在反应中得到2mol电子
潮湿的氯气通过盛有浓硫酸的洗气瓶 浓硫酸滴入萤石(CaF2)中加热生成HF 木材棍插入浓硫酸中变黑 淀粉溶液加入稀硫酸并加热转化为葡萄糖
此过程中有分解反应 此过程中S.元素的化合价未发生改变 使用此废气处理装置可减少酸雨的形成 整个过程的反应可表示为: 2SO2+2CaCO3+O2===2CaSO4+2CO2
反应②发生的是化合反应 可循环使用的物质是Na2SO3 NaHSO3中硫元素的化合价是+6 反应①说明SO2与CO2有相似的化学性质
电解过程中化学能转化为电能 吸收时的反应为  Na2SO3+SO2 + H2O 2NaHSO3 阴极区产生的气体X.是O2 该方法可减少酸雨的形成
Na2SO3+SO2 + H2O 2NaHSO3 阴极区产生的气体X.是O2 该方法可减少酸雨的形成
上述反应中,反应前后各元素的化合价都没有改变 KOH也能与SO2发生类似的反应 总的化学反应方程式可写为:2NaOH+SO2=Na2SO3+H2O 反应①是化合反应,反应②是置换反应
反应①中X.的化学式为NO 反应①、②都属于氧化反应 反应①、②中涉及的氧化物共有5种 化石燃料的燃烧是导致酸雨的“罪魁”

 生成 总反应可表示为
生成 总反应可表示为 还可能发生的反应有
还可能发生的反应有 还可能发生的反应有
还可能发生的反应有
 2CO 2SO2+ O2
2CO 2SO2+ O2  2SO3 S + O2
2SO3 S + O2  SO2 SO3+ H2O === H2SO4
SO2 SO3+ H2O === H2SO4

 Na2SO3+SO2 + H2O 2NaHSO3 阴极区产生的气体X.是O2 该方法可减少酸雨的形成
Na2SO3+SO2 + H2O 2NaHSO3 阴极区产生的气体X.是O2 该方法可减少酸雨的形成