你可能感兴趣的试题
C.(s)+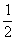 O2(g)=CO(g);△H.1C.(s)+O2(g)=CO2(g);△H.2
O2(g)=CO(g);△H.1C.(s)+O2(g)=CO2(g);△H.2 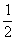 H2(g)+
H2(g)+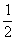 Cl2(g)=HCl(g);△H.1 H2(g)+Cl2(g)=2HCl(g);△H.2 2H2(g)+O2(g)=2H2O(g);△H.1 2H2(g)+O2(g)=2H2O(l);△H.2 S(g)+O2(g)=SO2(g);△H.1 S(s)+O2(g)=SO2(g); △H.2
Cl2(g)=HCl(g);△H.1 H2(g)+Cl2(g)=2HCl(g);△H.2 2H2(g)+O2(g)=2H2O(g);△H.1 2H2(g)+O2(g)=2H2O(l);△H.2 S(g)+O2(g)=SO2(g);△H.1 S(s)+O2(g)=SO2(g); △H.2
它们都是吸热反应 a、b和c均为正值 a=b 2b=c
2SO2(g)+O2(g)  2SO3(g) ΔH<0,t1时刻升高温度 4NH3(g)+5O2(g)
2SO3(g) ΔH<0,t1时刻升高温度 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0, t1 时刻增大O2浓度 C.(s)+H2O(g)
4NO(g)+6H2O(g) ΔH<0, t1 时刻增大O2浓度 C.(s)+H2O(g)  CO(g)+H2(g)ΔH>0,t1时刻升高温度 H2O(g)+CO(g)
CO(g)+H2(g)ΔH>0,t1时刻升高温度 H2O(g)+CO(g)  H2(g)+CO2(g) ΔH>0, t1时刻增大压强
H2(g)+CO2(g) ΔH>0, t1时刻增大压强
2H2(g)+O2(g) == 2H2O(1) △H.= —285.8kJ/mol 2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= —571.6 kJ/mol H2(g)+
2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= —571.6 kJ/mol H2(g)+ O2(g) == H2O(1) △H.= —285.8kJ/mol
O2(g) == H2O(1) △H.= —285.8kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H=-285.9 kJ / mol H2(g)+1/2O2(g)=H2O(l);△H=-241.8 kJ / mol H2(g)+1/2O2(g)=H2O(l);△H=+285.9 kJ / mol H2(g)+1/2O2(g)=H2O(g);△H=+241.8 kJ / mol
G01 G42 X50 Z-20 D01 G02 G41 X50 Z-20 D01 G03 G42 X50 Z-20 H01 G40 G43 X50 Z-20 H01
a>b,b=2c a=b=c a<b,c= a 无法比较
a 无法比较
由H+(aq)+OH-(aq)=H20(1) △H.=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ 由 (石墨)=C(金刚石) △H.=+1.9 kJ·mol-1,可知石墨比金刚石更稳定 C.由N2(g)+3H2(g)=2NH3(g) △H.=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ 由△G.=△H.-T△S.可知,所有的放热反应都能自发进行
拆开2 mol H2(g)和1 mol O2(g)中的化学键成为 H.、O.原子,共放出1368 kJ能量 由H.、O.原子形成2 mol H2O(g),共吸收1852 kJ能量 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),共吸收484 kJ能量 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量
由①、②知,2H2S(g)+O2(g)===2S(g)+2H2O(g) ΔH.=-443.4kJ/mol 由①知,氢气的燃烧热为241.8kJ 反应②中的能量变化可用如图表示 若反应②中改用固态硫,则放热大于20.1kJ
15g/24h~20g/24h <15g/24h <5g/24h <5g/8h <2g/24h

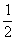 O2(g)=CO(g);△H.1C.(s)+O2(g)=CO2(g);△H.2
O2(g)=CO(g);△H.1C.(s)+O2(g)=CO2(g);△H.2 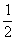 H2(g)+
H2(g)+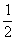 Cl2(g)=HCl(g);△H.1 H2(g)+Cl2(g)=2HCl(g);△H.2 2H2(g)+O2(g)=2H2O(g);△H.1 2H2(g)+O2(g)=2H2O(l);△H.2 S(g)+O2(g)=SO2(g);△H.1 S(s)+O2(g)=SO2(g); △H.2
Cl2(g)=HCl(g);△H.1 H2(g)+Cl2(g)=2HCl(g);△H.2 2H2(g)+O2(g)=2H2O(g);△H.1 2H2(g)+O2(g)=2H2O(l);△H.2 S(g)+O2(g)=SO2(g);△H.1 S(s)+O2(g)=SO2(g); △H.2
 2SO3(g) ΔH<0,t1时刻升高温度 4NH3(g)+5O2(g)
2SO3(g) ΔH<0,t1时刻升高温度 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0, t1 时刻增大O2浓度 C.(s)+H2O(g)
4NO(g)+6H2O(g) ΔH<0, t1 时刻增大O2浓度 C.(s)+H2O(g)  CO(g)+H2(g)ΔH>0,t1时刻升高温度 H2O(g)+CO(g)
CO(g)+H2(g)ΔH>0,t1时刻升高温度 H2O(g)+CO(g)  H2(g)+CO2(g) ΔH>0, t1时刻增大压强
H2(g)+CO2(g) ΔH>0, t1时刻增大压强
 2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= —571.6 kJ/mol H2(g)+
2H2(g)+ O2(g) == 2H2O(1) △H.= +571.6 kJ/mol 2H2(g)+O2(g) == 2H2O(g) △H.= —571.6 kJ/mol H2(g)+ O2(g) == H2O(1) △H.= —285.8kJ/mol
O2(g) == H2O(1) △H.= —285.8kJ/mol
 a 无法比较
a 无法比较