你可能感兴趣的试题
水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 乳酸(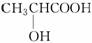 )有一对手性异构体,因为其分子中含有一个手性碳原子 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多
)有一对手性异构体,因为其分子中含有一个手性碳原子 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多
I2微溶于水,易溶于CCl4;HCl易溶于水 在水中的溶解度:C2H5OH>CH3CH2CH2CH2CH2OH 不同的烃之间相互溶解 I2易溶于KI溶液中
I2微溶于水,易溶于CCl4;HCl易溶于水 在水中的溶解度:C2H5OH>CH3CH2CH2CH2OH 不同的烃之间能相互溶解 I2易溶于KI溶液中
白磷(P4)易溶于CS2,也易溶于水 NaCl易溶于水,难溶于CCl4 碘易溶于苯,微溶于水 卤化氢易溶于水,难溶于CCl4
白磷(P4)易溶于CS2,但难溶于水 NaCl易溶于水,难溶于CCl4 碘易溶于苯,微溶于水 卤化氢易溶于水,也易溶于CCl4
碘易溶于四氯化碳,甲烷难溶于水,都可用“相似相溶”原理解释 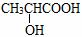 乳酸( )中存在一个手性碳原子 H2O比H2S稳定是由于水分子之间存在氢键 氯的各种含氧酸的酸性强弱顺序为HClO4>HClO3>HClO2>HClO
乳酸( )中存在一个手性碳原子 H2O比H2S稳定是由于水分子之间存在氢键 氯的各种含氧酸的酸性强弱顺序为HClO4>HClO3>HClO2>HClO
氯化氢易溶于水 用CCl4 萃取碘水中的碘 氯气易溶于NaOH溶液 苯与水混合静置后分层
二氧化硫易溶于水 用CCl4 萃取碘水中的碘 氯气易溶于NaOH溶液 苯与水混合静置后分层
碘易溶于四氯化碳,甲烷难溶于水,都可用“相似相溶”原理解释  乳酸( )中存在一个手性碳原子 H2O比H2S稳定是由于水分子之间存在氢键 氯的各种含氧酸的酸性强弱顺序为HClO4>HClO3>HClO2>HClO
乳酸( )中存在一个手性碳原子 H2O比H2S稳定是由于水分子之间存在氢键 氯的各种含氧酸的酸性强弱顺序为HClO4>HClO3>HClO2>HClO
氯化氢易溶于水 氯气易溶于NaOH溶液 碘易溶于CCl4 碘难溶于水
白磷(P4)易溶于CS2,但难溶于水 NaCl易溶于水,也易溶于CCl4 碘易溶于苯,微溶于水 卤化氢易溶于水,难溶于CCl4
碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子而HClO为0 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物
氯化氢易溶于水 氯气易溶于NaOH溶液
碘易溶于CCl4 碘难溶于水

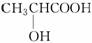 )有一对手性异构体,因为其分子中含有一个手性碳原子 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多
)有一对手性异构体,因为其分子中含有一个手性碳原子 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多
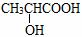 乳酸( )中存在一个手性碳原子 H2O比H2S稳定是由于水分子之间存在氢键 氯的各种含氧酸的酸性强弱顺序为HClO4>HClO3>HClO2>HClO
乳酸( )中存在一个手性碳原子 H2O比H2S稳定是由于水分子之间存在氢键 氯的各种含氧酸的酸性强弱顺序为HClO4>HClO3>HClO2>HClO
 乳酸( )中存在一个手性碳原子 H2O比H2S稳定是由于水分子之间存在氢键 氯的各种含氧酸的酸性强弱顺序为HClO4>HClO3>HClO2>HClO
乳酸( )中存在一个手性碳原子 H2O比H2S稳定是由于水分子之间存在氢键 氯的各种含氧酸的酸性强弱顺序为HClO4>HClO3>HClO2>HClO