
 2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
 CH4(g)+O2(g)=
CH4(g)+O2(g)=  CO2(g)+H2O(l) △H=-445 kJ/mol 己知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1,则C.(S)的燃烧热为-110. 5kJ/mol HF与NaOH 溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol
CO2(g)+H2O(l) △H=-445 kJ/mol 己知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1,则C.(S)的燃烧热为-110. 5kJ/mol HF与NaOH 溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol
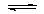 H2CO3+2OH- 氯化镁溶液与氨水反应:Mg2+ +2NH3•H2O==2NH4+ +Mg(OH)2↓ 氯气溶于水制备次氯酸:Cl2+H2O==2H+ +Cl-+ +ClO-
H2CO3+2OH- 氯化镁溶液与氨水反应:Mg2+ +2NH3•H2O==2NH4+ +Mg(OH)2↓ 氯气溶于水制备次氯酸:Cl2+H2O==2H+ +Cl-+ +ClO-
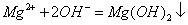
 CH4(g)+O2(g)===
CH4(g)+O2(g)=== CO2(g)+H2O(l) ΔH.=-445 kJ/mol 已知2C(s)+O2(g)===2CO(g) ΔH.=-221 kJ/mol,则C.的燃烧热为110.5 kJ/mol HF与NaOH溶液反应:H.+(aq)+OH-(aq)===H2O(l) ΔH.=-57.3 kJ/mol
CO2(g)+H2O(l) ΔH.=-445 kJ/mol 已知2C(s)+O2(g)===2CO(g) ΔH.=-221 kJ/mol,则C.的燃烧热为110.5 kJ/mol HF与NaOH溶液反应:H.+(aq)+OH-(aq)===H2O(l) ΔH.=-57.3 kJ/mol
 O2(g)=SO3(g);ΔH.=-315 kJ·mol-1 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l); ΔH.=-57.3 kJ·mol-1 表示H2燃烧热的热化学方程式H2(g)+
O2(g)=SO3(g);ΔH.=-315 kJ·mol-1 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l); ΔH.=-57.3 kJ·mol-1 表示H2燃烧热的热化学方程式H2(g)+ O2(g)=H2O(g);ΔH.=-241.8 kJ·mol-1 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);ΔH.=-566 kJ·mol-1
O2(g)=H2O(g);ΔH.=-241.8 kJ·mol-1 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);ΔH.=-566 kJ·mol-1
 2SO3(g) △H=-158.4kJ·mol-1 NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1 NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
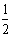 CH4(g)+O2(g)=
CH4(g)+O2(g)= 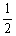 CO2(g)+H2O(l) △H=-445 kJ/mol 己知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1,则C.(S)的燃烧热为-110. 5kJ/mol HF与NaOH 溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol
CO2(g)+H2O(l) △H=-445 kJ/mol 己知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1,则C.(S)的燃烧热为-110. 5kJ/mol HF与NaOH 溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol