你可能感兴趣的试题
MgO、H2SO4、Na2O、CaCl2 CH4、CH3COOH、C2H5OH、H2O2 SO2、NaHSO4、Ca(OH)2、KCl MnO2、HNO3、Ba(OH)2、K2CO3
MgO、H2SO4、Na2O、CaCl2 MnO2、HNO3、NH3.H2O、K2CO3 SO2、NaHSO4、Ca(OH)2、KCl CH3OH、CH3COOH、C2H5OH、CH4
充电时电解质溶液的pH逐渐增大 放电时CH3OH参与反应的电极为正极 充电时每生成1 mol CH3OH转移6 mol电子 放电时负极的电极反应为:CH3OH-6e- +8OH- =CO + 6H2O
+ 6H2O
CH3OH 1/2CH3OH 1/3CH3OH 1/6CH3OH
C6H5O―+H2O+CO2→C6H5OH+HCO3―; CH3COO― 十 6H5OH→ CH3COOH+C6H5O―C.CH3COO―+HCOOH→CH3COOH+HCOO― CO32-+2CH3COOH→2CH3COO―+H2O+CO2↑
Fe2+/Fe(OH)3 Cu+/Cu(OH)2 Co2+/Co(OH)3 Cr3+/CrO42-
该电池的正极为锌 该电池反应中二氧化锰起催化剂作用 当65 g Zn完全溶解时,流经电极的电子为1mol 电池正极反应式为2MnO2+2e-+2H2O 2MnO(OH)+2OH-
2MnO(OH)+2OH-
CH3CH2OH(l)+3O2(g)=2CO2(g)+ 3H2O(l);△H=+1367kJ/mol 2CH3CH2OH(l)+6O2(g)=4CO2(g)+ 6H2O(l);△H=-2734kJ/mol 2CH3CH2OH(l)+6O2(g)=4CO2(g)+ 6H2O(l);△H=-1367kJ/mol 2CH3CH2OH(l)+6O2(g)=4CO2(g)+ 6H2O(l);△H=+2734kJ/mol
在CH3COONa 溶液中滴入无色酚酞,溶液变红: CH3COO- + H2O  CH3COOH + OH- 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐: 3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+ 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3 = Na+ + H+ + SO32- 在草酸溶液中滴入几滴稀H2SO4酸化的KMnO4溶液,溶液无色: 2MnO4- + 5H2C2O4 + 6H + = 2Mn2+ + 10CO2↑ + 8H2O
CH3COOH + OH- 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐: 3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+ 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3 = Na+ + H+ + SO32- 在草酸溶液中滴入几滴稀H2SO4酸化的KMnO4溶液,溶液无色: 2MnO4- + 5H2C2O4 + 6H + = 2Mn2+ + 10CO2↑ + 8H2O
放电时CH3OH参与反应的电极为正极 充电时电解质溶液的pH逐渐增大 放电时负极的电极反应为:CH3OH-6e- +8OH- =CO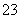 + 6H2O 充电时每生成1 mol CH3OH转移6 mol电子
+ 6H2O 充电时每生成1 mol CH3OH转移6 mol电子
金属铁溶于盐酸中:2Fe+6H+=2Fe3++3H2↑ 实验室用大理石和稀盐酸制取CO2:2H++CO32- = CO2↑+H2O 向AlCl3溶液中加入过量的氨水:Al3++3OH-= Al(OH)3↓ MnO2固体和浓盐酸反应制氯气:MnO2+4H++2Cl- 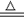 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
CH4、C2H2、C2H4、CH3CH=CH2 CH3CHO、CH3COOH、CH3CH2OH C6H5OH、C6H5C2H5、C6H5CH3、C6H6 炭粉、MnO2、CuO、FeS
放电时CH3OH参与反应的电极为正极 充电时电解质溶液的pH逐渐增大 放电时负极的电极反应为:CH3OH.-6e-+8OH- = CO32— + 6H2O 充电时每生成1 mol CH3OH转移6 mol电子
2NaHCO3 = Na2CO3+CO2↑+H2O
2KMnO4 = K2MnO4+MnO2+O2↑
Ca(OH)2+CO2=CaCO3↓+H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
CH3OH 1/2CH3OH 1/3CH3OH 1/6CH3OH
2KMnO4 K2MnO4+MnO2+O2 Ca(OH)2+CO2=CaCO↓+H2O 3Fe+2O2 Fe3O4 4NH3+5O2 4NO+6H2O
CH3―C6H4―OH CH3―C6H4―OCH3 CH3―(CH2)6―OH CH3―C6H4―CH2―OH
Fe3+、Na+、SO42-、H2O2 C.2H5OH、MnO4-、H+ 、K+ Pb2+、K+ 、SO42-、Cl- Na+、SO32- 、CH3COO-、AIO2-
该电池的正极为锌 该电池反应中二氧化锰起催化剂作用 当65g Zn完全溶解时,流经电极的电子1mol 电池正极反应式为MnO2+e-+H2O MnO(OH)+OH-
MnO(OH)+OH-
Fe3+、Na+、SO42-、H2O2 C.2H5OH、MnO4-、H+ 、K+ Pb2+、K+ 、SO42-、Cl- Na+、SO32- 、CH3COO-、S2-

 + 6H2O
+ 6H2O
 2MnO(OH)+2OH-
2MnO(OH)+2OH-
 CH3COOH + OH- 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐: 3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+ 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3 = Na+ + H+ + SO32- 在草酸溶液中滴入几滴稀H2SO4酸化的KMnO4溶液,溶液无色: 2MnO4- + 5H2C2O4 + 6H + = 2Mn2+ + 10CO2↑ + 8H2O
CH3COOH + OH- 在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐: 3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+ 在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3 = Na+ + H+ + SO32- 在草酸溶液中滴入几滴稀H2SO4酸化的KMnO4溶液,溶液无色: 2MnO4- + 5H2C2O4 + 6H + = 2Mn2+ + 10CO2↑ + 8H2O
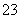 + 6H2O 充电时每生成1 mol CH3OH转移6 mol电子
+ 6H2O 充电时每生成1 mol CH3OH转移6 mol电子
 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
 MnO(OH)+OH-
MnO(OH)+OH-