你可能感兴趣的试题
两种溶液的pH:盐酸大于醋酸
用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多
向醋酸中加入等物质的量的NaOH,溶液呈碱性,且溶液中
两种溶液中水电离出的氢离子:盐酸大于醋酸
两溶液的导电能力相同 分别稀释100倍后,溶液pH相同 盐酸中水的电离程度比醋酸中的小 分别与足量Zn反应时,醋酸中生成的n(H2)较多
中和10 mL 0.1 mol·L-1 醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同 常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L 分别加水稀释100倍后,两种溶液的pH仍相同ks5u 醋酸中的c(CH3COO-)和硫酸中的c(SO )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 分别加入足量锌片,两种溶液生成H2的体积相同
常温下,测得醋酸钠溶液的pH>7 常温下,测得0.1mol/L醋酸溶液的pH=4 常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸中的c(CH3COO-)和硫酸中的c(SO )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性 已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强 将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O) 常温下,pH均为5的醋酸和硫酸铝溶液,由水电离出的氢离子浓度均为1×10-9 mol·L-1
某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a﹥b 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 常温下,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0 常温下,若1 mL pH=1的盐酸与100 mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
常温下,pH=8的碱性溶液中不可能存在H2CO3分子
常温下,pH.均为5的盐酸与氯化铵溶液中,水的电离程度相同
0.1mol/LCH3COOH溶液加水稀释,溶液的pH.和CH3COOH的电离度均增大
将BaCl2溶液滴入含酚酞的Na2CO3溶液,红色褪去,说明BaCl2溶液显酸性
两种溶液中,由水电离出的氢离子浓度均为l×10-11 mol·L-1
分别加水稀释100倍后,两种溶液的pH仍相等
中和同体积的这两种酸溶液所需要NaOH物质的量也相等
分别加入足量锌片,两种溶液生成H2的体积相等
常温下,向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 0.1 mol·L-1的醋酸加水稀释,c(CH3COOH)/c(CH3COO-)减小 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸中的c(CH3COO-)和硫酸中的c(SO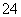 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等 常温下,测得0.1 mol·L-1醋酸溶液的pH=4 常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 在相同条件下,醋酸溶液的导电性比盐酸的弱
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸溶液中的c(CH3COO-)和硫酸中的c(SO42-)相等 分别加入足量锌片,两种溶液生成H2的体积相同
两种溶液中,由水电离出的氢离子浓度均为l×10-11 mol·L-1
分别加水稀释100倍后,两种溶液的pH仍相等 中和同体积的这两种酸溶液所需要NaOH物质的量相等
分别加入足量锌片,两种溶液生成H2的体积相等
常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 常温下,将pH=3的硫酸和pH=11的氨水等体积混合后,所得溶液的pH>7 常温下,将醋酸溶液与NaOH 溶液等体积混合后,若所得溶液的pH=7,则原溶液中c(CH3COOH)>c(NaOH) 常温下,pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-)
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol·L-1 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸中的c(CH3COO-)和硫酸中的c(SO )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
pH=2的盐酸中:c(H+)=c(Cl-) + c(OH-) pH=3的醋酸中:c(H+)=3.0 mol·L.-1 pH=2的盐酸与pH=3的醋酸中溶质的物质的量浓度之比为10:1 pH=3的醋酸与pH=11的NaOH溶液等体积混合所得溶液中:c(Na+)=c(CH3COO-)
常温下,向醋酸溶液中加入少量的水,溶液中所有离子浓度均将减小 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变 常温下,2NO(g)+2CO(g)=N2(g)+2CO2(g)能自发进行,则该反应的△H>O


 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
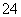 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同