你可能感兴趣的试题
正反应速率加快 正反应速率减慢 逆反应速率加快 无法判断
升高温度该反应的正反应速率增大,逆反应速率减小 该反应的化学平衡常数表达式为K.= 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
%和C.%随温度的变化曲线如图所示,下列说法正确的是 A.该反应在T1、T3温度时达到过化学平衡 该反应在T2温度时达到过化学平衡 该反应的逆反应是放热反应 升高温度,平衡会向正反应方向移动
密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入 催化剂 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
该反应在T1、T3温度时达到过化学平衡 该反应在T2温度时达到过化学平衡 该反应的逆反应是放热反应 升高温度,平衡会向正反应方向移动
该反应的正反应是吸热反应 该反应的逆反应是放热反应 该反应的正反应是放热反应 温度对该反应无影响
正反应是吸热反应,且A.不是气态 正反应是放热反应,且A.是气态 其他条件不变,加入少量A.,该平衡向正反应方向移动 改变压强对该平衡的移动无影响
可逆反应的特征是正反应速率和逆反应速率相等 在其它条件不变时,升高温度可以使化学平衡向放热反应的方向移动 在其它条件不变时,增大压强一定会破坏气体反应的平衡状态 在其它条件不变时,使用催化剂可改变化学反应速率,但不能改变化学平衡状态
正反应是放热反应,m+n<p+q 逆反应是放热反应,m+n>p+q 正反应是放热反应,m+n>p+q 逆反应是放热反应,m+n<p+q
体积不变,升温,正反应速率减小 温度、压强均不变,充入HI气体,开始时正反应速率增大 温度不变,压缩气体的体积,平衡不移动,颜色加深 混和气体的密度不变,表示该反应达到平衡状态
升高温度,正反应速率增大,逆反应速率减小 若正反应是放热反应,则A.为气态 若向容器中充入惰性气体,则平衡向右移动 物质A.一定为非气态,且正反应是吸热反应
升高温度该反应的正反应速率增大,逆反应速率减小 该反应的化学平衡常数表达式为K.= 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
x+y>z+w,正反应是放热反应 x+y>z+w,正反应是吸热反应
x+y<z+w,逆反应是放热反应 x+y>z+w,逆反应是吸热反应
该反应的正反应是吸热反应 该反应的逆反应是放热反应 该反应的正反应是放热反应 温度对该反应无影响
正反应是放热反应,逆反应是吸热反应 正逆反应都是吸热反应 正逆反应都是放热反应 正反应是吸热反应,逆反应是放热反应
该反应的逆反应是放热反应 该反应的正反应是放热反应 该反应的正反应是吸热反应 温度对该反应无影响
(g)+y (g)
 z (g)+w (g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( ) A.若x+y>z+w,正反应是放热反应 B.若x+y>z+w,正反应是吸热反应 C.若x+yz+w,逆反应是吸热反应
z (g)+w (g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( ) A.若x+y>z+w,正反应是放热反应 B.若x+y>z+w,正反应是吸热反应 C.若x+yz+w,逆反应是吸热反应
升高温度,正反应速率增大,逆反应速率减小 若正反应是放热反应,则A.为气态 物质A.一定为非气态,且正反应是吸热反应 若向容器中充入惰性气体,则平衡向右移动
升高温度,正反应速率增大,逆反应速率减小 正反应是放热反应,则A.为气态 若向容器中充入惰性气体,则平衡向右移动 物质A.一定为非气态,且正反应是吸热反应
(s)+ 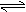
 达到平衡后,B.的转化率与压强、温度的关系如图所示。下列说法正确的是( )
达到平衡后,B.的转化率与压强、温度的关系如图所示。下列说法正确的是( )  A.B.是固体,C.是固体,正反应是吸热反应 B.B.是气体,C.是固体,正反应是吸热反应 C.B.是气体,C.是固体,正反应是放热反应 B.C.都是气体,正反应是放热反应
A.B.是固体,C.是固体,正反应是吸热反应 B.B.是气体,C.是固体,正反应是吸热反应 C.B.是气体,C.是固体,正反应是放热反应 B.C.都是气体,正反应是放热反应

 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应

 z (g)+w (g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( ) A.若x+y>z+w,正反应是放热反应 B.若x+y>z+w,正反应是吸热反应 C.若x+y
z (g)+w (g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( ) A.若x+y>z+w,正反应是放热反应 B.若x+y>z+w,正反应是吸热反应 C.若x+y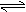
 达到平衡后,B.的转化率与压强、温度的关系如图所示。下列说法正确的是( )
达到平衡后,B.的转化率与压强、温度的关系如图所示。下列说法正确的是( )  A.B.是固体,C.是固体,正反应是吸热反应 B.B.是气体,C.是固体,正反应是吸热反应 C.B.是气体,C.是固体,正反应是放热反应 B.C.都是气体,正反应是放热反应
A.B.是固体,C.是固体,正反应是吸热反应 B.B.是气体,C.是固体,正反应是吸热反应 C.B.是气体,C.是固体,正反应是放热反应 B.C.都是气体,正反应是放热反应