你可能感兴趣的试题
0.10mol·L-1的醋酸溶液和0.01mol·L-1醋酸溶液中水的电离程度 将PH=4的盐酸和醋酸分别稀释成PH=5的溶液所加水的体积 物质的量浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液中NH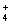 的浓度 相同温度、相同物质的量浓度的CH3COONa溶液和Na2CO3溶液的PH
的浓度 相同温度、相同物质的量浓度的CH3COONa溶液和Na2CO3溶液的PH
容量瓶中原有少量蒸馏水 溶液从烧杯转移到容量瓶中后没有洗涤烧杯 滴管加水时,有少量水滴到容量瓶外 加水未达到刻度线
容量瓶中原有少量蒸馏水 溶液从烧杯转移到容量瓶中后没有洗涤烧杯和玻璃棒 定容时观察液面俯视 定容时平视液面
1mol/L的醋酸溶液中H+浓度约为10-3mol/L 醋酸能与水以任意比互溶 10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应 醋酸的导电性比强酸溶液弱
将NaOH溶液和氨水溶液各稀释一倍,二者的OH-浓度均减小到原来的一半 如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度是醋酸的两倍 强电解质溶液的导电能力一定比弱电解质溶液强 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需NaOH和醋酸所需NaOH相等
烧杯②中溶液一定含有盐酸 烧杯③中一定没有盐酸 烧杯③中溶液为氯化锌溶液 烧杯③中的固体只有铁
pH等于5的醋酸溶液 一定浓度的NaOH溶液 一定浓度的NaHSO4溶液 一定浓度的NH4Cl溶液
容量瓶中有少量蒸馏水 溶液从烧杯转移到容量瓶中后没有洗涤烧杯 定容时观察液面时俯视 滴管加水时,有少量水滴到容量瓶外
强电解质溶液的导电能力一定比弱电解质溶液强 因醋酸是弱电解质,盐酸是强电解质,因而中和等体积、等物质的量浓度的醋酸和盐酸时,盐酸消耗的NaOH比醋酸多。 NaHCO3溶于水,溶液中存在电离平衡。 物质的量浓度相同的磷酸钠溶液和磷酸溶液中C.(PO43-)相同。
强电解质溶液的导电能力一定比弱电解质溶液强 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠等于醋酸 将氢氧化钠和氨水溶液各稀释一倍,两者的 OH-浓度均减少到原来的 1/2 如果盐酸的浓度是醋酸浓度的2倍,则盐酸的H+浓度也是醋酸的2倍
容量瓶中原有少量蒸馏水 溶液从烧杯转移到容量瓶中后没有洗涤烧杯 定容时俯视液面 滴管加水时,有少量水滴到容量瓶外
pH由小到大的顺序是①< ②< ③< ④ 溶液中水电离出的H+浓度由小到大的顺序是②<①<④<③ 取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③ 取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b约为11:9
25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1 此溶液中KCl的质量分数为 20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
将质量分数为40%(密度为1.43g·cm-3)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数是20% 要配制浓度为0.25mol·L-1的NaOH溶液480mL,应称量4.8gNaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配浓度偏高 配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低
容量瓶中原有少量蒸馏水 溶液从烧杯转移到容量瓶中后没有洗涤烧杯 定容时观察液面俯视 滴管加水时,有少量水滴到容量瓶外

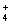 的浓度 相同温度、相同物质的量浓度的CH3COONa溶液和Na2CO3溶液的PH
的浓度 相同温度、相同物质的量浓度的CH3COONa溶液和Na2CO3溶液的PH
 20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3